arrehenius https://www.youtube.com/watch?v=oeFcEjmIXgs
bronsted,lowry https://www.youtube.com/watch?v=SRvwDqseBXY
arrhenius
Svante Arrhenius, un científico sueco, realizó importantes descubrimientos en química, sobre todo relacionado con las disociaciones de compuestos en disolución acuosa (lo que le valió ser galardonado con el Premio Nobel de Química en 1903). Dentro de lo más importante que formulo este químico se encuentra su Teoría ácido-base, la cual se verá aquí muy superficialmente, tan solo dando las conclusiones de su estudio.
Según Svante, un ácido era aquella sustancia química capaz de liberar iones hidrógeno en medio acuoso, mientras que una base era aquella sustancia química capaz de dejar iones hidroxílos en disolcuión acuosa. Esta definición tenía ciertas limitantes, como las que se ennumeran a continuación:
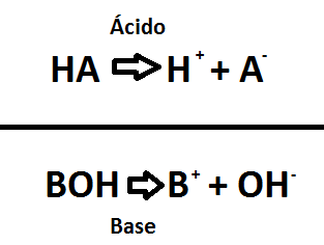
En la Imagen DAA-1 se representan un ácido (arriba) y una base (abajo), de manera general, según como las veía S. Arrhenius. Mientras que en la Imagen DAA-2 se puede apreciar una imágen 3D del ión hidroxílo.
Imágen DAA-1: Representaciones de un ácido de Arrhenius (arriba) y una base de Arrhenius (arriba) culaquiera. Tener en cuenta que en ambos casos se consideró medio acuoso.
Según Svante, un ácido era aquella sustancia química capaz de liberar iones hidrógeno en medio acuoso, mientras que una base era aquella sustancia química capaz de dejar iones hidroxílos en disolcuión acuosa. Esta definición tenía ciertas limitantes, como las que se ennumeran a continuación:
- Esta teoría es válida únicamente ne medio acuoso, ya que en otro solvente no necesariamente ocurre tal cuál.
- Esta teoría no considera a los ácidos no-proticos, los cuales se ven incapaces de liberar iones hidrógenos, ni a las bases deshidroxiladas, incapaces de liberar iones hidroxílos.
En la Imagen DAA-1 se representan un ácido (arriba) y una base (abajo), de manera general, según como las veía S. Arrhenius. Mientras que en la Imagen DAA-2 se puede apreciar una imágen 3D del ión hidroxílo.
Imágen DAA-1: Representaciones de un ácido de Arrhenius (arriba) y una base de Arrhenius (arriba) culaquiera. Tener en cuenta que en ambos casos se consideró medio acuoso.
bronsted,lowry
La teoría de Brønsted-Lowry es una teoría de reacción ácido-base que fue propuesta independientemente por Johannes Nicolaus Brønsted y Thomas Martin Lowry en 1923.12 El concepto fundamental de esta teoría es que cuando un ácido y una base reaccionan entre sí, el ácido forma su base conjugada y la base forma su ácido conjugado mediante el intercambio de un protón (el catión hidrógeno o H+). Esta teoría es una generalización de la teoría de Arrhenius .
Comparación con la teoría del ácido-base de Lewis[editar]
En el mismo año en que Brønsted y Lowry publicaron su teoría, G. N. Lewis propuso una teoría alternativa de las reacciones ácido-base. La teoría de Lewis se basa en la estructura electrónica . Una base de Lewis se define como un compuesto que puede donar un par de electrones a un ácido de Lewis , un compuesto que puede aceptar un par de electrones. 12 13 La propuesta de Lewis da una explicación a la clasificación de Brønsted-Lowry en términos de estructura electrónica.
- HA + B: ⇌ A:- + BH+
En esta representación, tanto la base, B como la base conjugada, A - , se muestran con un par de electrones aislados y el protón, que es un ácido de Lewis, se transfiere entre ellos.
Lewis escribió más tarde en "Para restringir el grupo de ácidos a aquellas sustancias que contienen hidrógeno interfiere tan seriamente con la comprensión sistemática de la química como lo haría la restricción del término agente oxidante a sustancias que contienen oxígeno ". 13 En la teoría de Lewis, un ácido, A y una base, B : forman un aducto, AB, en el que el par de electrones se usa para formar un enlace covalente dativo entre A y B. Esto se ilustra con la formación del aducto H3N − BF3 del amoníaco y el trifluoruro de boro , una reacción que no puede ocurrir en una solución acuosa porque el trifluoruro de boro reacciona violentamente con el agua en una reacción de hidrólisis.
- BF3 + 3H2O → B (OH)3 + 3HF
- HF ⇌ H+ + F-
Estas reacciones ilustran que BF3 es un ácido en las clasificaciones de Lewis y Brønsted-Lowry y enfatiza la consistencia entre ambas teorías.
El ácido bórico es reconocido como un ácido de Lewis en virtud de la reacción.
- B (OH) 3 + H 2 O ⇌ B(OH)−
4 + H +
En este caso el ácido no se disocia, es la base, H2O la que se disocia. Una solución de B (OH) 3 es ácida porque los iones de hidrógeno se liberan en esta reacción.
Hay pruebas sólidas de que las soluciones acuosas diluidas de amoníaco contienen cantidades insignificantes de ion amonio.
- H2O + NH3 ⥇ OH - + NH+
4
y que, cuando se disuelve en agua, el amoníaco funciona como una base de Lewis.


No hay comentarios:
Publicar un comentario